Bahan Buatan Dalam Industri
👉 ASID SULFURIK
Asid sulfurik , H₂SO₄, ialah cecair yang tak berwarna tetapi sangat berbahaya kerana sangat mengkakis dan boleh mengakibatkan melecur.
Asid sulfurik menyerap air dengan mudah. Oleh itu, asid sulfurik biasanya digunakan dalam makmal sebagai agen pengontangan untuk mengeringkan gas seperti hidrogen, klorin dan sulfur dioksida.
Pembuatan Asid Sulfurik
Asid sulfurik diperlukan dalam kebanyakan pembuatan bahan kimia .
Proses Sentuh adalah bertujuan untuk menghasilkan asid sulfurik.Proses ini melibatkan empat peringkat.
Bahan mentah yang digunakan ialah sulfur,udara dan air.
-
PERINGKAT 1 : Pembentukan sulfur dioksida
Leburan sulfur dibakar di dalam udara kering untuk menghasilkan sulfur dioksida, SO₂. Gas yang terbentuk ditulenkan dan disejukkan .
S + O₂ ➟ SO₂
-
PERINGKAT 2 : Pembentukam sulfur trioksida
Sulfur dioksida , SO₂ dan gas oksigen, O₂ yang berlebihan disalurkan melalui mangkin vanadium (V) oksida. V₂O₅ pada suhu 450℃ dan tekanan 1 atm (atmosfera) untuk menghasilkan sulfur trioksida, SO₃.
2SO₂ + O₂ ⥨ 2SO₃Kira-kira 99,5% sulfur dioksida , SO2 ditukarkan kepada sulfur trioksida , SO₃ melalui tindak balas berbalik itu.
-
PERINGKAT 3 : Pembentukan oleum
Sulfur trioksida , SO₃ dilarutkan di dalam asid sulfurik, H₂SO₄ pekat untuk membentuk oleum , H₂S₂O₇.
SO₃ + H₂SO₄ ➟ H₂S₂O₇
-
PERINGKAT 4 : Pencairan oleum
Oleum , H₂S₂O₇ dicairkan denagan air untuk menghasilkan asid sulfurik , H₂SO₄ pekat dalam kuantiti yang banyak.
H₂S₂O₇ + H₂O ➟ 2HSO₄
Proses Sentuh
melibatkan tiga tahap: Pembuatan sulfur dioksida S + O2 ----------------
SO2 Penukaran sulfur dioksida ke sulfur trioksida 2SO2 + O2
--------------- 2SO3 Suhu: 400C - 450C Tekanan: 1 atmosfera Nisbah bahan
tindakbalas: Nisbah SO2 kepada O2 ialah 1:1 Mangkin: Vanadium(V) Oksida
V2O5 Penukaran sulfur trioksida ke oleum dan akhirnya ke asid sulfurik
H2SO4 + SO3 ---------- H2S2O7 Sebatian H2S2O7 dikenali sebagai oleum.
Apabila oleum dilarutkan dalam air, asid sulfurik akan terhasil: H2S2O7 +
H2O ----------- 2H2SO4 * Oleum dihasilkan sebagai hasil perantaraan
kerana melarutkan sulfur trioksida secara terus ke dalam air adalah amat
berbahaya kerana proses ini akan membebaskab banyak haba. (walaupun
asid sulfurik boleh dihasilkan sebegitu). * Tindak balas penghasilan
sulfur trioksida daripada sulfur dioksida adalah satu tindak balas
berbalik. Maka suhu, tekanan, mangkin dan nisbah bahan tindak balas
adalah amat penting demi memaksimumkan kuantiti sulfur trioksida yang
terhasil.
Make Google view image button visible again: https://goo.gl/DYGbub
Make Google view image button visible again: https://goo.gl/DYGbub
Make Google view image button visible again: https://goo.gl/DYGbub
Proses Sentuh
melibatkan tiga tahap: Pembuatan sulfur dioksida S + O2 ----------------
SO2 Penukaran sulfur dioksida ke sulfur trioksida 2SO2 + O2
--------------- 2SO3 Suhu: 400C - 450C Tekanan: 1 atmosfera Nisbah bahan
tindakbalas: Nisbah SO2 kepada O2 ialah 1:1 Mangkin: Vanadium(V) Oksida
V2O5 Penukaran sulfur trioksida ke oleum dan akhirnya ke asid sulfurik
H2SO4 + SO3 ---------- H2S2O7 Sebatian H2S2O7 dikenali sebagai oleum.
Apabila oleum dilarutkan dalam air, asid sulfurik akan terhasil: H2S2O7 +
H2O ----------- 2H2SO4 * Oleum dihasilkan sebagai hasil perantaraan
kerana melarutkan sulfur trioksida secara terus ke dalam air adalah amat
berbahaya kerana proses ini akan membebaskab banyak haba. (walaupun
asid sulfurik boleh dihasilkan sebegitu). * Tindak balas penghasilan
sulfur trioksida daripada sulfur dioksida adalah satu tindak balas
berbalik. Maka suhu, tekanan, mangkin dan nisbah bahan tindak balas
adalah amat penting demi memaksimumkan kuantiti sulfur trioksida yang
terhasil.
Make Google view image button visible again: https://goo.gl/DYGbub
Make Google view image button visible again: https://goo.gl/DYGbub
Make Google view image button visible again: https://goo.gl/DYGbub
Proses Sentuh
melibatkan tiga tahap: Pembuatan sulfur dioksida S + O2 ----------------
SO2 Penukaran sulfur dioksida ke sulfur trioksida 2SO2 + O2
--------------- 2SO3 Suhu: 400C - 450C Tekanan: 1 atmosfera Nisbah bahan
tindakbalas: Nisbah SO2 kepada O2 ialah 1:1 Mangkin: Vanadium(V) Oksida
V2O5 Penukaran sulfur trioksida ke oleum dan akhirnya ke asid sulfurik
H2SO4 + SO3 ---------- H2S2O7 Sebatian H2S2O7 dikenali sebagai oleum.
Apabila oleum dilarutkan dalam air, asid sulfurik akan terhasil: H2S2O7 +
H2O ----------- 2H2SO4 * Oleum dihasilkan sebagai hasil perantaraan
kerana melarutkan sulfur trioksida secara terus ke dalam air adalah amat
berbahaya kerana proses ini akan membebaskab banyak haba. (walaupun
asid sulfurik boleh dihasilkan sebegitu). * Tindak balas penghasilan
sulfur trioksida daripada sulfur dioksida adalah satu tindak balas
berbalik. Maka suhu, tekanan, mangkin dan nisbah bahan tindak balas
adalah amat penting demi memaksimumkan kuantiti sulfur trioksida yang
terhasil.
Make Google view image button visible again: https://goo.gl/DYGbub
Make Google view image button visible again: https://goo.gl/DYGbub
Make Google view image button visible again: https://goo.gl/DYGbub
Sulfur trioksida tidak dilarutkan secara langsung ke dalam air untuk menghasilkan asid sulfurik.
SO₃ + H₂O ➝ H₂SO₄
Hal ini kerana tindak balas antara sulfur trioksida dengan air sanagat eksotermik. Haba yang terbebas dalam tindak balas akan mengewapkan cecair asid sulfurik kepada wasap aisd sulfurik . Wasap asid sulfurik bersifat mengakis , mencemarkan udara dan sukar dikondensasikan .
Kegunaaan Asid Sulfurik
1. Penghasilan baja
3. Sebagai elektrolit dalam bateri kereta
4. Pembuatan pestisid
5. Pembuatan pencelup , pigmen dan cat
6. Pembuatan gentian buatan seperti nilon dan rayon
7. Metalurgi : Menyingkirkan lapisan oksida logam daripada permukaan logam semasa mencuci
logam
8. Digunakan untuk proses kulit haiwan
9. Sebagai agen pengontang
10.Sebagai mangkin
Pencemaran Alam Sekitar oleh Sulfur Dioksida
Sulfur dioksida merupakan sejenis gas buangan daripada
penghasilan proses Sentuh dan kilang-kilang pemprosesan bahan kimia . Sulfur
dioksida larut dalam air hujan membentuk hujan asid . Hujan asid mempunyai
nilai pH antara 2.4 dan 5.0 .
2SO₂ + O₂ +
2H₂O ➝ 2H₂SO₄
Kesan hujan asid :
-mengakis bangunan dan arca
-mengakis sruktur bahan logam
-mengurangkan nilai pH dalam tanah,menghauskan nutrien tanah,melarutkan garam
mineral dan memusnahkan tumbuhan
-meningkatkan keasidan air dan kehidupan akuatik terjejas
Cara mengurangkan pembebasan gas sulfur dioksida ke atmosfera
Melakukan tindak balas antara sulfur dioksida dengan,
- ammonia / ammonium hidroksida untuk menghasilkan ammonium sulfat . (digunakan sebagai baja pertanian)
- kalsium hidroksida / kalsium karbonat untuk , menghasilkan kalsium sulfat . (digunakan dalam penghasilan plaster dan simen )
👉AMMONIA
Ammonia terdidri daripada 1 atom nitrogen dan 3 atom hidrogen dengan formula kimia , NH₃ .Ammonia wujud sebagai gas pada suhu bilik .
Sifat-sifat :
- bersifat alkali
- gas tidak berwarna
- berbau sengit
- kurang tumpat daripada air
- sangat larut dalam air
- menghasilkan wasap putih apabila bertindak balas dengan gas hidrogen klorida,HCl .
Kegunaan Ammonia
Ammonia merupakan sumber yang membekalkan unsur nitrogen . Unsur nitrogen penting untuk tumbesaran tumbuh-tumbuhan .
Kegunaan utama ammonia adalah dalam penghasilan baja bernitrogen . Baja bernitrogen termasuklah ammonium sulfat , (NH₄)₂SO₄ , ammonium nitrat , NH₄NO₃ , AMMONIUM FOSFAT , (NH₄)₃PO₄ dan urea CO(NH₂)₂ .
1. Penghasilan baja ammoniumsulfat
2. Membuat agen pembersih
3. Pembuatan bahan letupan ammonium nitrat
4. Membuat ammonium klorida (elektrolit) dalam sel kering
5. Pembuatan bahan penyejuk
6. Pembuatan gentian sintetik
7. Pembuatan asid nitrik
8. Pembuatan pulpa kertas , laker dan varnis
Pembuatan ammonia
Ammonium dihasilkan dalam industri melalui Proses Haber . Dalam proses ini, gas nitrogen , N₂ daripada udara dipadukan dengan gas hidrogen H₂ daripada gas asli untuk membentuk ammonia , NH₃ .
Bahan mentah yang digunakan ialah gas hidrogen dan gas nitrogen.
Peringkat pembuatan ammonia :
Campuran N₂ (dari udara) dan H₂ (dari gas asli) pada nisbah 1 : 3 dalam pemampat
↓
Campuran dimampatkan (suhu 450℃, tekanan 200 atm)
↓
Campuran dialirkan melalui mangkin besi : N₂ + 3H₂ ⥨ 2NH₃
(Gas N₂ dan H₂ yang tidak bertindak balas dialir semula ke kompresor)
↓
Gas NH₃ disejukkan
Penyediaan baja ammonium
| Langkah 1: | Larutan ammonia + asid → garam ammonium | |
| Langkah 2: | Garam ammonium disejatkan untuk mendapatkan larutan tepu garam ammonium | |
| Langkah 3: | Larutan tepu garam ammonium disejukkan dan dihablurkan untuk mendapatkan baja ammonia |
| Larutan ammonia + asid sulfurik → Ammonium sulfat | ||
| Larutan ammonia + asid nitrik → Ammonium nitrat | ||
| Larutan ammonia + asid fosforik → Ammonium fosfat |
Hitung peratus komposisi mengikut jisim bagi nitrogen dalam setiap sebatian bahan
Eksperimen Menyediakan Hablur Ammonium Sulfat , (NH₄)₂SO₄
Ammonium sulfat ialah sejenis baja kimia
Radas : Buret , kelalang kon , mangkuk pijar , kertas turas , corong turas , penunu bunsen , dawai
kuasa
Bahan : Larutan ammonia , NH₃ 1.0 mol dm⎻³ , asid sulfurik , H₂SO₄ 1.0 mol dm⎻³, penunjuk metil
jingga
Prosedur :
- Titrat larutan ammoniake dalam 50 cm ³ asid sulfurik cair sehingga penunjuk berubah warna daripada kuning ke jingga
- Ulangi pentitratan tanpa penunjuk
- Pekatkan larutan ammonium sulfat secara memanas sehingga 1/3 isi pada asal.
- Biarkan larutan pekat ammonium sulfat sejuk ke suhu bilik
- Apabila hablur ammonium sulfat terbentuk,turaskan campuran
- Keringkan hablur ammonium sulfat di antara dua keping kertas turas
Kesimpulan : Garam ammonium sulfat boleh dihasilkan melalui tindak balas antara larutan ammonia dengan asid sulfurik
👉ALOI
Aloi adalah campuran dua atau lebih logam (seperti gangsa atau loyang) atau logam dengan sedikit bukan logam (seperti keluli).
Susunan atom dalam logam
Logam tulen mempunyai sifat-sifat yang berikut
- Berkilat
- Ketumpatan tinggi
- Konduktor elektrik
- Mulur
- Berkilat
- Boleh ditempa
Tujuan menghasilkan aloi :
- menambahkan kekuatan dan kekerasan logam
- mengurangkan kakisan logam
- menjadikan logam kelihatan lebih menarik
| Aloi | Komposisi | Sifat | Kegunaan |
|---|---|---|---|
| Keluli | Besi 99.9% Karbon 0.5% |
Keras, kuat | Membina rumah, jambatan, mesin, kenderaan dan sebagainya |
| Piuter | Timah 97% Antimoni dan kuprum 3% |
Permukaan yang berkilat, tahan kakisan | Membuat barangan perhiasan seperti bingkai gambar |
| Gangsa | Kuprum 88% Timah 12% |
Keras, tidak berkarat | Membuat duit syiling, pisau dan sebagainya |
| Loyang | Kuprum 75% Zink 25% |
Kuat, permukaan berkilat, mudah ditempa | Membuat kunci, alatan muzik dan sebagainya |
| Duralumin | Aluminium 95% Kuprum 3% Magnesium 1% Mangan 1% |
Ringan, kuat, tahan kakisan | Membuat badan kenderaan seperti bas, kapal terbang, kereta api dan sebagainya |
Eksperimen
Tujuan :
Untuk mengkaji kekerasan logam tulen dan aloinya
Pernyataan masalah :
Adakah aloi lebih keras daripada logam tulennya?
Hipotesis :
Gangsa lebih keras daripada kuprum
Pemboleh ubah :
- Dimanipulasikan : jenis bahan
- Bergerak balas : diameter lekuk pada bongkah
- Dimalarkan : tinggi pemberat , jisim pemberat, diameter bebola keluli
Kaki retort dan pengapit , pemberat 1 kg , bebola keluli , pembaris meter dan benang
Bahan :
Bongkah kuprum , bongkah gangsa dan pita selofan
Prosedur :
- Sebiji bebola keluli dilekatkan pada permukaan bongkah kuprum dengan menggunakan pita selofan.
- Pemberat 1 kg digantung setinggi 50cm di atas bebola keluli seperti rajah di atas.
- Pemberat itu dilepaskan supaya jatuh pada bongkah bebola keluli.
- Diameter lekuk yang terhasil pada permukaan bongkah kuprum diukur dan direkodkan.
- Langkah 1 hingga 4 diulang sebanyak 2 kali pada tempat yang berlainan pada bongkah kuprum untuk mendapatkan purata diameter lekuk yang terbentuk .
- Langkah 1 hingga 5 diulang menggunakan bongkah gangsa untuk menggantikan bongkah kuprum.
Bongkah
|
Diameter lekuk (cm)
|
Purata (cm)
|
||
1
|
2
|
3
|
||
Kuprum
|
||||
Gangsa
|
||||
Perbincangan :
1. Purata diameter lekuk pada bongkah gangsa lebih kecil berbanding purata diameter lekuk pada bongkah kuprum
2. Semakin keras bongkah , semakin kecil
purata diameter lekuk yang dihasilkan
3. Definisi secara operasi bagi kekerasan :
Diameter lekuk yang lebih kecil yang
terbentuk apabila pemberat 1 kg dijatuhkan ke atas bongkah
4. Berikan inferens berdasarkan pemerhatian :
Diameter lekuk yang kecil menunjukkan
bongkah itu lebih keras manakala diameter lekuk yang besar menunjukkan bongkah itu kurang keras
5. Terangkan mengapa aloi lebih keras
daripada logam tulennya :
Aloi lebih keras daripada logam tulennya
kerana kehadiran atom timah yang lebih
besar mengganggu susunan atom kuprum
yang teratur menyebabkan ia sukar untuk
menggelongsor antara satu sama lain
Kesimpulan :
Hipotesis diterima . Gangsa lebih keras daripada kuprum .
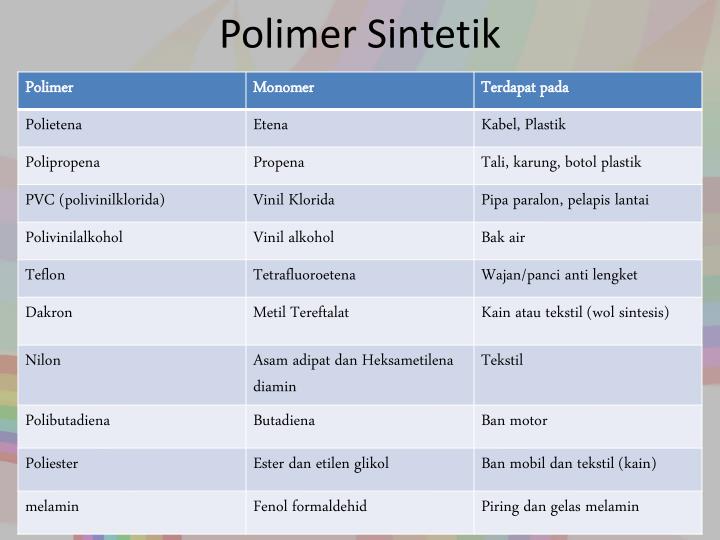
👉POLIMER SINTETIK
Polimer ialah molekul besar , berantai panjang yang terbina daripada gabungan secara ikatan kovalen, banyak ulangan unit kecil yang dinamakan monomer . Monomer bersambung melalui ikatan kovalen menjadi satu satu rantai yang panjang dan proses ini dinamakan pempolimeran .
Polimer dibahagi kepada dua jenis :
- Polimer semula jadi - polimer yang wujud di alam semula jadi dalam tumbuhan dan haiwan .
- ( protein , karbohidrat(kanji) , getah asli )
- Polimer sintetik - hasil buatan manusia
Kesan Pembuangan polimer sintetik ke atas Alam Sekitar
- Pencemaran air - plastik yang tersumbat akan menyebabkan air tidak dapat mengalir dengan terus . Oleh itu , kehidupan hidupan akuatik akan terjejas .
- Pencemaran udara
- Pencemaran tanah - plastik yang dibuang merata - rata tempat meningkatkan kadar pencemaran tanah . Jadi , tanah menjadi tidak sesuai bagi aktiviti pertanian .
- Kitar semula
- Terbiodegradasi
- Penggantian
- Penukaran
- Pengunaan semula
👉KACA dan SERAMIK
Kaca diperbuat daripada pasir yang dipanaskan bersama limestone sehingga 1600℃ dan kemudian disejukkan semula. Komponen utama kaca ialah silika , SiO₂ atau pasir .
Seramik pula diperbuat daripada tanah liat . Proses pembuatannya memerlukan tindakan haba yang tinggi . Kaolin ialah tanah liat yang terdiri daripada aluminosilikat terhidrat , Al₂O₃.2SiO₂.2H₂O .

Sifat seramik
- tahan haba
- kuat, boleh menahan tekanan tinggi
- tidak mudah melebur
- sangat keras tetapi rapuh
- lengai terhadap bahan kimia
- tidak mudah terkakis
- penebat haba dan elektrik yang baik membolehkannya untuk dibuat pelelas , bahan binaan , penebat dalam alatan elektrik dan alatan pembiasan .
👉BAHAN KOMPOSIT
Bahan komposit ialah bahan baharu hasil daripada campuran dua atau lebih bahan seperti logam , aloi, kaca , seramik dan polimer . Bahan yang terhasil ini mempunyai sifat gabungan bahan asalnya .






















Terima kasih! Nota yang padat untuk saya ulang kaji pelajaran 😊👍
ReplyDeleteCongratulation Rhunidha ..
ReplyDelete